Detección molecular de mollicutes en el cultivo de maíz
Zea mays

- Sistema productivo:
- Maíz
- Cobertura geográfica:
-
Regiones de los Valles Interandinos, Orinoquía, Caribe y Pacífica

Descripción
La enfermedad del achaparramiento del maíz es causada por los mollicutes Candidatus Phytoplasma asteris o MSBP (por sus siglas en inglés Maize Bushy Stunt Phytoplasma) y el Spiroplasma kunkelii o CSS (por sus siglas en inglés Corn Stunt Spiroplasm), los cuales son trasmitidos a las plantas por medio del saltahojas Dalbulus maidis, quien es su vector. Esta enfermedad se ha convertido en la principal limitante sanitaria de este cultivo, tanto para la producción de grano como de silo, afectando el rendimiento promedio en cosecha. La enfermedad ya se encuentra en diferentes regiones productoras de maíz en Colombia, en donde se ha evidenciado la necesidad de contar con herramientas diagnósticas que permitan una detección temprana de los patógenos en insectos adultos de Dalbulus maidis y en tejido vegetal de maíz, para la toma de decisiones de manejo agronómico del cultivo; y así obtener rendimientos económicamente rentables para el agricultor.
Con este protocolo es posible detectar molecularmente los dos mollicutes Candidatus Phytoplasma asteris (MSBP) y Spiroplasma kunkelii (CSS), a partir de tejido vegetal e insectos adultos de Dalbulus maidis colectados en campo.
Para cada ciclo productivo, se recomienda realizar dos detecciones de los mollicutes: una en insectos de Dalbulus maidis previo a establecimiento del cultivo y otra en tejido vegetal 40 días después de emergencia de las plantas. Una muestra estará compuesta por la recolección de tejido vegetal o insectos vectores de cinco puntos en una hectárea, para que sea representativa.
El contar con un diagnóstico oportuno en insecto o planta, le permite al agricultor implementar estrategias de manejo y control de la enfermedad con el fin de alcanzar la etapa de cosecha. De la misma manera, permite determinar si los patógenos están presentes dentro de adultos de Dalbulus maidis y si estos últimos son factores de riesgo en el área a cultivar, permitiendo implementar las medidas necesarias para mitigar su efecto en las zonas productoras de maíz.
El diagnóstico temprano de la enfermedad permite al productor y entidades de control establecer un plan de manejo del cultivo. Además, permitirá realizar aplicaciones basadas en el monitoreo, lo cual disminuye el uso excesivo de agroquímicos para el control del vector.
¿Cómo tomar la muestra de tejido vegetal para el análisis?
Para el muestreo de tejido vegetal es importante recolectar muestras de plantas que se encuentren ubicadas en el borde del lote, debido a que existe relación entre el ingreso al lote, movimiento y transmisión de los mollicutes por el insecto vector Dalbulus maidis a las plantas (Fig. 1A). Adicionalmente debe contarse con marcador permanente y bolsas de papel de 15 cm x 6 cm aprox. (Fig. 1B).

Momento de Muestreo
Los muestreos deben realizarse en la etapa vegetativa del cultivo de maíz. Es decir, cuando las plantas posean desde 3 hojas completamente desarrolladas (V3) hasta 10 hojas completamente desarrolladas (V10) idealmente antes de la floración (Fig. 2B), ya que esta etapa de desarrollo correspondería con una fase de desarrollo de la planta tardía para realizar el diagnóstico, pues en caso de tener un resultado positivo no será posible implementar estrategias para manejar la enfermedad y evitar que se afecte en un alto porcentaje la cosecha (Fig. 2).

Recolección de muestras en campo y embalaje para evitar degradación
En el predio, se deben seleccionar cinco (5) plantas de acuerdo con la figura 1A. De cada planta ubicar una hoja del tercio medio de la cual se cortará un fragmento de tejido de 10 cm x 5 cm aprox. de diámetro incluyendo la nervadura central. Posteriormente, los fragmentos recolectados de cada planta deberán ser depositados completamente extendidos dentro una misma bolsa de papel. La bolsa deberá externamente ser marcada con la identificación de la muestra (Fig. 3).

¿Cómo recolectar la muestra de insectos para análisis?
Para el muestreo de insectos adultos de Dalbulus maidis es importante llevar a cabo el muestreo antes del establecimiento del lote en cultivos aledaños y malezas del borde del lote (Fig. 5) o en las etapas de emergencia del cultivo (Fig. 2A). Realizar muestreos y los respectivos análisis en etapas posteriores que resulten positivos no permitirán la implementación de estrategias de manejo para controlar al insecto vector que disminuyan la diseminación de los mollicutes en el lote.
El muestreo debido a los materiales requeridos y acondicionamiento de la muestra para la detección se recomienda sea realizada por el agrónomo o asistente técnico del agricultor. Para el muestreo son necesarios: jama entomológica, marcador permanente, alcohol antiséptico al 70%, tubos o recipientes plástico con capacidad de 15 a 50 ml. (Fig. 4).

Muestreo
La recolección se lleva a cabo realizando 5 pases dobles de jama en un metro lineal del predio con cinco repeticiones (Fig. 5). Posterior a la realización de los 10 pases dobles de jama concentrar la muestra en la base de la jama (Fig. 6A). Introducir la base de la jama en el vial con alcohol y porsteriomente y recolectar por raspado en tubo o recipiente plástico de 15 a 20 ml de capacidad con alcohol antiséptico al 70% (Fig. 6B y 6C). Las muestras recolectadas en campo hasta su acondicionamiento pueden almacenarse en refrigeración (4 – 10°C).

Acondicionamiento de muestras para envío
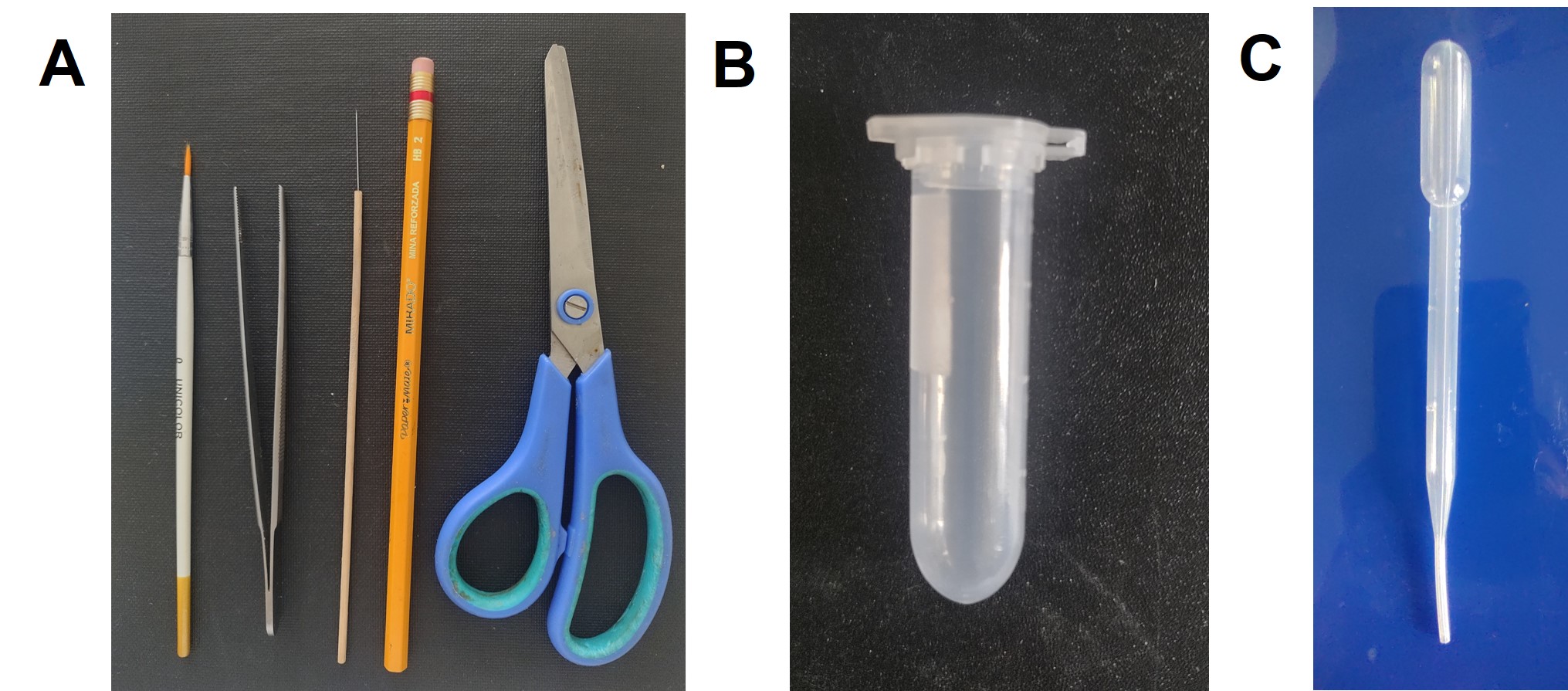
Una vez colectadas las muestras en campo es necesario seleccionar los adultos morfológicamente relacionados con el género Dalbulus y prepararlos para el envío. Para este proceso de selección y limpieza son requeridos tubos eppendorf de 2 ml, alcohol antiséptico al 70%, pincel número cero, lápiz HB No. 2, tijeras, asa recta, pinzas entomológicas, pipeta Pasteur y papel opalina (Fig. 7).
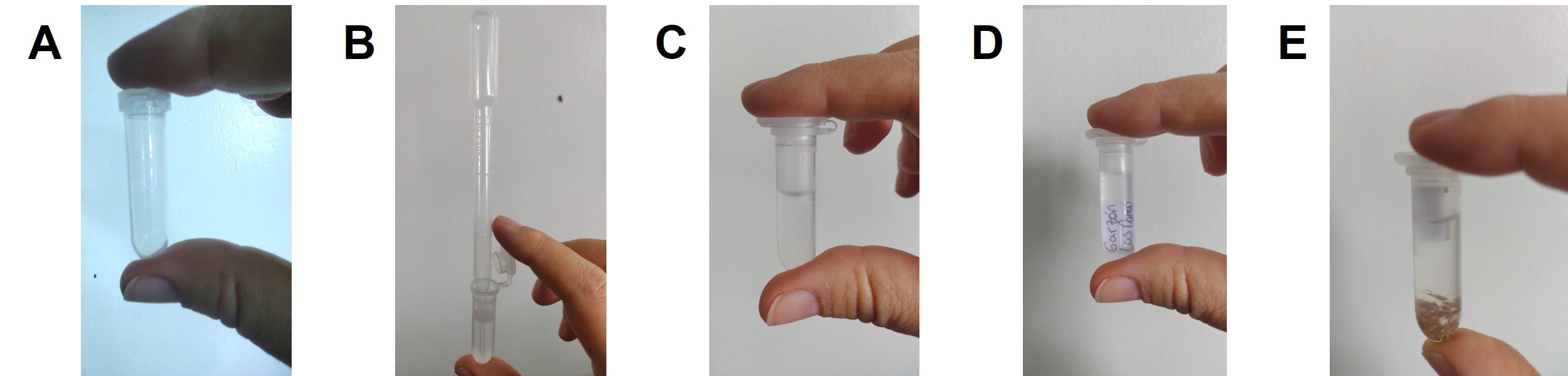
Adicionar 1 ml de alcohol antiséptico al 70% a tubo eppendorf de 2 ml con pipeta Pasteur. Posteriormente introducir una etiqueta de papel opalina marcada con lápiz donde se identifique la muestra. Por último, dispensar la muestra colectada en el tubo de o recipiente plástico de 15 a 50 ml proveniente de campo en una caja Petri, con el apoyo del asa recta y el pincel seleccionar los adultos morfológicamente asociados con el género Dalbulus, e introducirlos en el tubo (Fig. 8).
Publicaciones
- Artículo: Design of a polymerase chain reaction for specific detection of corn stunt spiroplasma. Plant Disease, 85(5), 475–480.
- Artículo: PCR assay for detection of the phytoplasma associated with maize bushy stunt disease. Plant Disease, 80(3), 263–269
Galería de imágenes





Más información
En el correo atencionalcliente@agrosavia.co en la línea única nacional (601) 9144677 o al WhatsApp (+57) 3162387122.






